Cálculo de la cantidad de agua producida en la combustión completa de una botella de butano de una estufa catalítica, y
cantidad de aire necesario para la combustión completa de modo que no se produzca monóxido de carbono.
Cálculo del agua producida en forma de vapor.
Fórmula del butano:
CH3(CH2)2CH3, lo que podemos representar como C4H10.
Peso atómico de los diferentes elementos que intervienen en el proceso de combustión: Carbono, 12,011; Hidrógeno, 1,008; Oxígeno, 16.
La ecuación del proceso de combustión es:
C4H10 + O2 -----> CO2 + H2O
Una vez igualada, la ecuación correspondiente a la combustión del butano es:
2C4H10 + 13O2 -----> 8CO2 + 10H2O
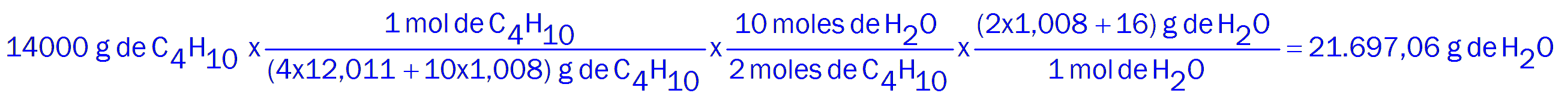
Aproximadamente 21,7 litros de agua.
Cálculo del volumen de aire necesario para la combustión completa.
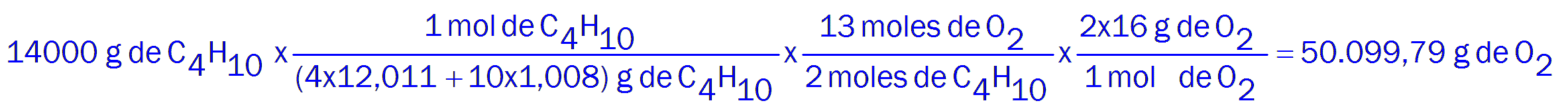
Densidad absoluta del oxígeno (a 0ºC y 760 mm Hg), 1,42904 g/litro.
Litros de oxígeno necesarios:
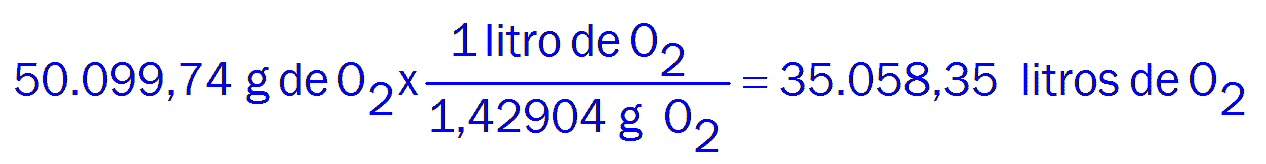
Concentración de Oxígeno en el aire, por volumen: 20,99%
Litros de aire necesario:

Volumen de aire necesario:
Aproximadamente, 167 m3.
Conclusiones.
La combustión completa de una botella de butano de 14 kg en un aparato de gas de circuito abierto (el aire para la combustión
lo toma del local en el que está) y de evacuación no conducida (los productos de la combustión los descarga directamente en el
ambiente), como puede ser una estufa catalítica, una cocina, una encimera o un hornillo, genera aproximadamente 21,7 litros de vapor
de agua que aumentan la humedad absoluta del aire ambiente del local y que deben ser eliminados bien mediante ventilación u otro
sistema de deshumidicación para evitar aumentar el riesgo de condensaciones superficiales.
Para una correcta combustión de modo que no se forme monoxido de carbono, se necesitan también 167 m3 de aire. En locales
pequeños, cerrados y que carezcan de ventilación o esta sea insuficiente, el riesgo de formación de CO puede ser elevado. Y
el CO, produce muertes todos los años.
Puede enviar sus comentarios o sugerencias a:
malvarez@ingenieriaypdi.com